Präparation von Phaseolus Polytänchromosomen (Riesenchromosomen)
 |
 |
Beschichten der Objektträger
- OT in einer Küvette mit Aceton 5 min spülen und luftrocknen
- im vorderen Drittel des OT 4 µl Poly-L-Lysin Lösung auftropfen
- den Tropfen mit einem zweiten OT ausstreichen und an der Luft trocknen lassen
Material, Chemikalien und Lösungen
- 10 µl-Pipette
- Glasküvette
- Aceton, technisch
- Poly-L-Lysin (mw 100.000, Sigma, P-1274), 1 mg/ml in A. dest.
Fixieren der Samen
- Hülsen ernten (hier meist vormittags) und in einer großen, verschließbaren Plastiktüte (hier mit zwei großen Büroklammern) 1 - 3 Tage bei +4°C lagern.
- Die Hülsen mit einer scharfen Klinge an der Naht der Länge nach aufschneiden und den Gewebeteil mit dem Embryo Suspensor herrauspräparieren. Dazu öffnet man den Samen mit einem schräg verlaufenden Oberflächenschnitt (siehe Abbildung a) und schneidet den Gewebeteilt möglichst eng aus (s. Abbildung b).
- Die Gewebeteile 3 - 7 Tage werden dann bei +4°C gelagert, wobei das Fixans nach den ersten 24 h einmal gewechselt werden sollte.
 |
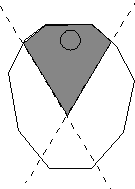 |
| Abb. a: Oberflächenschnitt (Längsschnitt) | Abb. b: Ausschneiden des Gewebeteils unterhalb der Mikrophyle mit dem Suspensor Embryo. (Querschnitt) |
Präparation
- fixierte Samen/Gewebestücke aus 70% Ethanol bei - 20°C in 70% Ethanol bei RT überführen und 5 min auf Rotationsschüttler bei geringer Umdrehungszahl schütteln
- Ethanol gegen Aqua dest. auswechseln und 2x 10 min, wie oben, schütteln. Hinweis: Die Samen sollten nach 20 bis 30 min auf den Boden absinken. Wenn die Umdrehungszahl zu hoch ist brauchen die Samen länger um abzusinken!
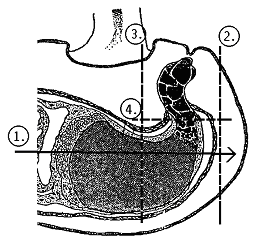
- unter dem Stereomikroskop die Samenschale mit einem Oberflächenschnitt von der Mitte des Samens in Richtung Mikropyle bis zur äußeren Samenschale hin öffnen (1). Dabei sollte der Schnitt möglichst tief, d.h. so nahe an das Suspensorgewebe wie möglich, geführt werden. Den Suspensor und möglichst wenig umliegendes Gewebe mit drei Schnitten (2)-(4) herauspräparieren ("Gewebestück")
- 30 Gewebestücke in 10 ml MES-Sucrose-Puffer 3 mal kurz spülen und anschließend in ein Plastik-Schnappdeckelgläschen mit ca. 15 ml 10% Pektinase überführen
- Gewebestücke 3 h in einem Inkubationsschüttler bei 120 rpm bei 37°C enzymatisch mazerieren
- Pektinase-Gemisch abgießen 3 Mal mit MES-Sucrose-Puffer waschen
- 3 h in 5 ml Propionsäure-Milchsäure (1:1) bei RT fixieren
- 3 Mal in A. dest. spülen und dann 1-2 h bei +4°C stehen lassen
- ein Gewebestück in einige Tropfen 45% Essigsäure auf einen Hohlschliffobjektträger überführen
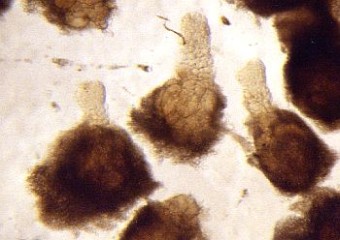
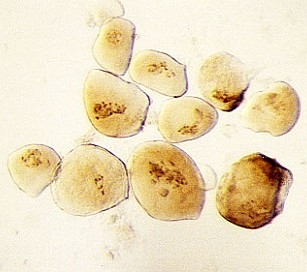
- die einzelnen Zellen des Suspensors mit Präpariernadel und Pinzette aus dem Gewebestück herauspräparieren (s. Foto RC2 und RC3)
- die größten Suspensorzellen mit sehr klarem und durchsichtigem Cytoplasma aussortieren (wenn in einem Suspensor nicht ausreichend viele dieser Zellen zu finden sind, mehrere Suspensoren präparieren bis genügend Zellen zur Verfügung stehen)
- 8-10 Zellen mit einer 20 µl-Pipette (mit abgeschnittener Spitze) in 15 µl 45% Essigsäure aufnehmen und auf einen mit Poly-L-Lysin-beschichteten Objektträger übertragen Alternativ, für Leute mit einer ruhigen Hand:
- die einzelnen Suspensorzellen so auf dem OT verteilen, daß sie sich beim späteren "Aufklatschen" des DG (siehe unten) nicht überlagern
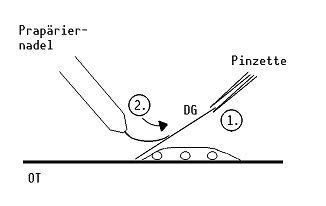
- mit einer Pinzette ein DG aufnehmen, dieses mit einer Kante schräg auf den OT aufsetzen und festhalten (1); durch Andrücken mit einer Präpariernadel an der aufgesetzten Stelle, das DG unter Spannung setzen (2)
- durch pötzliches Wegziehen der Pinzette "klatscht" das DG auf die Zellen auf, die Zellwände platzen und die Riesenchromosomen werden aus den Suspensorzellen herausgequetscht
- DG mit einem Stück Filterpapier abdecken und mit der Rückseite einer Präpariernadel durch leichtes und senkrechtes (!) Klopfen von oben auf das DG, die Chromosomen noch etwas mehr vereinzeln
- OT auf einer Kälteplatte (-70°C) einfrieren und DG mit einer Rasierklinge "absprengen" (Trockeneis-Methode nach Conger und Fairchild, 1953)
- Präparate in 99% Ethanol entwässern und über Nacht an der Luft trocknen
- Position des Präparates am Rand des OT mit Diamantschreiber kennzeichnen!
 |
 |
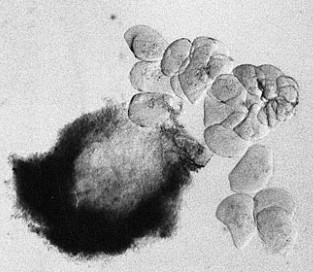
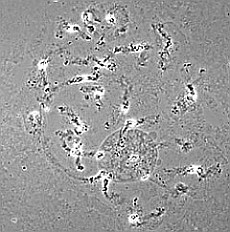
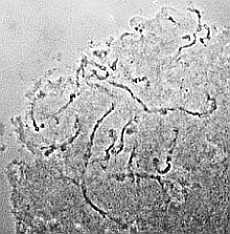
| RC2: Die Zellen eines Suspensor befreit von umgebenden Gewebe | RC3: Die grossen Zellen (10) eines Suspensors in dem sich die Riesnchromsomen als "dunkle Faeden" abzeichnen |

 |
 |
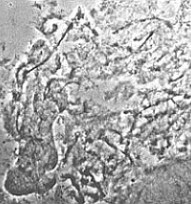 |
gut |
mittelmässig |
nicht zu gebrauchen |
Material
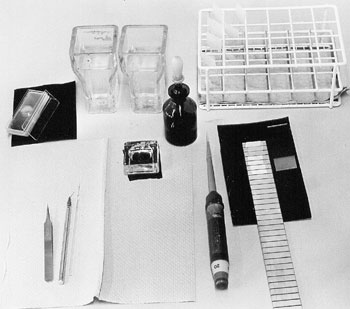 |
 |
| Instrumente | Lichtmikrsokope |
- Skalpel, Präpariernadel, feine Pinzette, Pasteurpipette
- Deckgläser, 18x18mm
- Objektträger, mehrer Hochlschliff-Objektträger
- Filterpapier
- Kälteplatte, Rasierklinge, Diamantschreiber
- Plastik-Schnappdeckelbehälter (100 ml)
- 20µl-Pipette, abgeschnittene 200µl-Spitzen
Chemikalien und Lösungen
- MES (2[N-Morpholino] ethanesulfonic acid) (Sigma, M-3023)
- Sucrose (SERVA, 35580)
- Pectinase from mould, 0.0095 units/mg (Fluka, 76290)
- 45% Essigsäure
- Propionsäure, 99.5%
- Milchsäure, DL-Lactic acid
- 99% vergällten Ethanol
- MES-Sucrose-Medium: 25 mM MES, pH 5.5 mit 6% (w/v) Sucrose

